EMEの土屋で御座います。前回のコラムで予告しましたが、今回のコラムでは担当研究者の望月博士とともに細胞内の標的分子に対するIntrabody(細胞内VHH)のライブラリー化についてご紹介します。創薬の領域ではいよいよmRNA医薬品の実用化が急速に進み始めました。これにより細胞内分子を標的とするIntrabodyを利用した医薬品がますます現実味を帯びてきています。今回、Intrabodyを簡便かつ速やかに提供できるライブラリーの構築に成功したので、ご紹介させていただきます。本コラムを通じて技術の理解を深めていただき、多くの方々との共同研究に繋げられれば幸いです。創薬における細胞内の環境は未開の宇宙であり、思いもよらぬ創薬アイデアの創出が起こりうる領域です。閉塞感がある創薬分野に、新たなイノベーションの風を吹き込む絶好のチャンスではないでしょうか?
それでは以下にIntrabodyについて紹介します。
Intrabodyは抗体を研究している方であれば、決して目新しい技術ではなく、一本鎖抗体分子(scFv)を用いたIntrabody構築に関する論文がこれまでに多数発表されています。筆者も英国MRCから戻りました翌年1993年にはIntrabodyの研究を行いました。この時は転写因子E2Fを標的に設定し、モノクローナル抗体を生産するハイブリドーマを購入し、ここから抗体のH鎖およびL鎖の可変領域をクローニングしてscFvを構築しました。組変え体のscFvがE2Fへ結合することを確認したうえでIntrabodyとしての検討に進みました。細胞内の標的オルガネラは核内でしたので、scFvのC末端に核移行シグナルを連結して、アフリカミドリザル由来のCOS細胞に導入しました。蛍光試薬を用いて細胞内局在を調べると、scFvが核内に局在化し、E2Fと結合していることが確認できました。当時はまだ医薬品の開発へと先に進める環境になく、実験はここで中断となりましたが、それ以来Intrabodyのアイデアが頭の中を巡っていました。
その後、長年の月日を経て、私は単ドメイン抗体の一種であるVHHを扱うこととなり、再びIntrabodyの医薬化を考えるに至りました。EMEではVHHと抗原複合体のX線結晶構造化解析のデータに基づいてPharmaLogical® Libraryのデザイン・構築を実施して、数多くの標的分子に対するVHHを速やかに取得するスクリーニング・プラットフォーム“The Month”の構築に成功しました。一方で、熱安定性・構造安定性に優れていると言われるVHHですが、必ずしもIntrabodyとして機能するわけではないことが報告されています¹。そこで、Intrabodyのスクリーニングについても迅速かつ簡便に取得するためにIntrabodyライブラリーの構築を検討することと致しました。それが今回のコラム紹介技術です。
この技術の開発にあたり、scFvをIntrabodyとして用いるための先行技術を参考としました。scFvは多くの場合細胞内の環境下で凝集してしまうことが分っていました。その課題に対して、陰性電荷のペプチドタグを付加することで、細胞内の環境で凝集せずに安定的に発現可能なscFv:STANDが報告されています²。STAND技術の特に重要なポイントとして、pH6.6で十分に陰性電荷をもつことがscFvの凝集抑制に重要であることが示されています。
この情報を参考に、我々はVHHのフレームワーク領域(FR)を陰性電荷FRに改変することを計画しました。詳細はいずれ論文の中で紹介できればと思いますが、バイオインフォマティクスとDirected evolutionを用いてVHHの構造形成を保った陰性電荷FRをデザインしました。そして、その陰性電荷FRからなるVHHライブラリーを構築し、Intrabodyライブラリーとしました。このライブラリーを用いたスクリーニングは細胞内の還元条件やpHを考慮して実施できるのがポイントです。試しにKRASに対してスクリーニングを実施し、得られたクローンの内2種類を遺伝子発現ベクターにて細胞内で発現させたところ、想定通りKRASに結合できていることを確認できました。現在、機能(薬理)評価を実施しているところです。また、その他の複数の細胞内シグナル伝達に関係する分子についてIntrabodyの取得を試みているところです。
細胞内への導入は、はさらに各種のオルガネラ(核、ER、ミトコンドリア、そして細胞質)にIntrabodyを局在化させる工夫が必要となりますが、それぞれに必要な局在化シグナル配列が同定されており活用されています。例えば、ERリテンションシグナル(KDEL)を付加することで、Intrabodyを介してタンパク質の分泌を阻害するアイデアも報告されています³ 。また、標的を分解するためのユビキチン・プロテアソーム蛋白分解経路を活用するアイデア(低分子化合物を用いる例としてはPROTACSが有名です)も注目されています。
ところで、Intrabodyを細胞内で機能させるには、現状では遺伝子として細胞内に導入し、細胞内で翻訳されて、機能させる必要があります。mRNAの細胞導入が直接的で望ましいのです。近年、コロナワクチンの成功によりmRNA医薬品が世界規模で市民権を得たように思います。つまり、今後は数多くのIntrabodyがいよいよ臨床開発のステージに移行してくると予想しています。
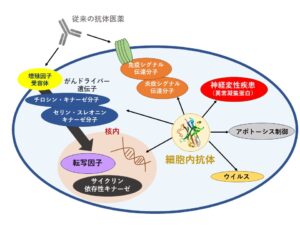
図1 細胞内創薬標的分子
図1は細胞内の標的に関する概念をまとめたものです。特に細胞内では蛋白-蛋白相互作用(PPI)を標的とした創薬アイデアがIntrabodyによって証明されるかも知れません。Intrabodyライブラリーの活用によって数々の標的に対するIntrabodyの薬理作用が確認され、臨床にて応用されることを期待しています。9月頃のコラムにてEMEで検討を進める様々の標的から得られる知見を紹介したいと思います。
参考文献
1) Dingus et al. Elife. 2022;11:e68253.
2) Kabayama et al. Nat Commun. 2020 17;11(1):336
3) Marschall et al. MAbs. 2015; 7(6): 1010–1035.

